我院袁泉教授团队在tRNA修饰对骨骼发育的调控方面取得重要进展
近日,我院袁泉教授与周陈晨教授团队,联合中山大学陈德猛教授,在揭示tRNA N7-甲基鸟嘌呤(m7G)修饰调控骨骼发育的机制方面取得了重要进展。研究成果以“Metabolic rewiring during bone development underlies tRNA m7G-associated primordial dwarfism”为题,发表在国际顶尖医学期刊The Journal of Clinical Investigation上。袁泉教授,陈德猛教授和周陈晨教授为本文通讯作者,我院博士后李奇文和博士生姜爽为本文共同第一作者。

tRNA在蛋白质合成中扮演关键角色,其分子结构受到多种化学修饰,研究报道tRNA修饰异常与多种发育性疾病和癌症的发生密切相关。2015年,研究报道tRNA m7G修饰的缺失导致一类原发性侏儒,患者表现为四肢短小、口腔颅颌面畸形和神经系统异常,然而其发病机制仍不清楚。研究团队通过条件性敲除tRNA m7G修饰酶METTL1或突变支架蛋白WDR4,构建了基因敲除/突变小鼠模型,发现Mettl1敲除或Wdr4突变不仅会导致长骨发育的显著延迟,还会造成严重的骨矿化不足。具体表现为小鼠胚胎时期的骨骼生长受限,并且在出生后表现出与原发性侏儒症相似的体型矮小症状。

机制研究发现,Mettl1基因的敲除显著减少了m7G修饰的tRNA的数量,抑制了与细胞骨架和Rho GTP酶信号通路相关的mRNA翻译。同时,尽管Mettl1敲除导致细胞增殖和成骨分化能力下降,但细胞能量代谢反而增强。进一步研究发现,受损的Rho GTP酶信号通路上调了支链氨基酸转氨酶1(BCAT1)的表达,重塑了细胞代谢并限制了细胞内α-酮戊二酸(αKG)的水平。通过补充αKG,显著改善了Mettl1缺陷小鼠的骨骼发育缺陷。
此外,研究团队还发现,tRNA m7G修饰缺失触发了一种细胞保护机制,即通过整合应激反应(ISR)和mTORC1信号通路的调控,抑制蛋白质合成以应对细胞应激状态。这一机制通过抑制翻译起始,避免了由于tRNA功能缺陷导致的核糖体碰撞和应激,但与此同时也加重了骨骼发育缺陷。
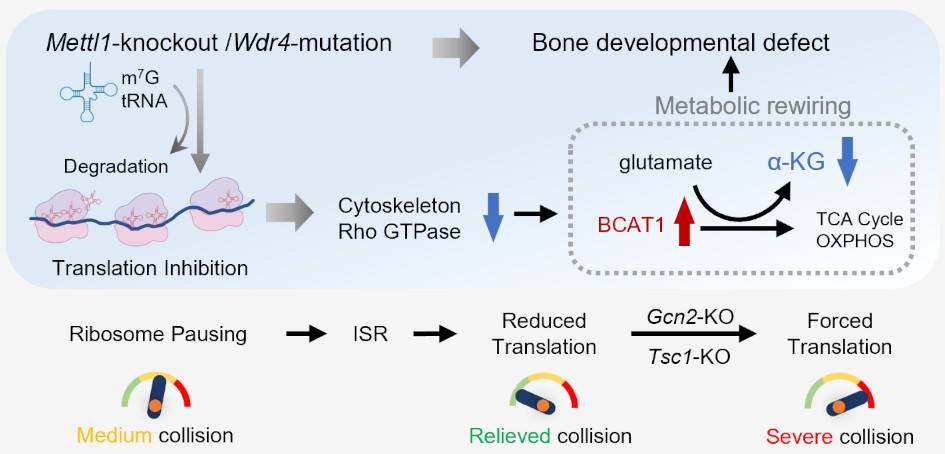
总之,本研究首次系统性地揭示了tRNA m7G修饰对骨骼发育的关键调控作用,并深入阐明了该修饰通过调控RNA翻译和细胞代谢导致骨骼畸形的机制。这一研究为理解tRNA修饰在器官发育中的作用提供了新思路,为tRNA异常所导致的原发性侏儒患者的治疗提供了新的潜在策略。未来,该团队将继续深入探究其它tRNA修饰在颅颌面发育性疾病中的作用,并力求将这些研究成果转化为精准治疗的新策略。
原文链接:https://www.jci.org/articles/view/177220